为了提高生麦曲的发酵效率及品质,江南大学粮食发酵工艺与技术国家工程实验室/食品学院、江南大学(绍兴)产业技术研究院周志立、刘双平、毛健和浙江古越龙山绍兴酒股份有限公司国家黄酒工程技术研究中心徐岳正、周建弟、应维茂以传统草包曲的制作工艺为基础,将生小麦经现代通风控温控湿工艺培养后制成仿草包曲,分别比较仿草包曲与对照块曲的酶活性能和微生物群落结构、仿草包曲与对照块曲所酿黄酒理化指标、风味物质含量。结果表明:仿草包曲的酶活性能高于对照块曲;仿草包曲的细菌群落结构与对照块曲基本相似,但不同属真菌的相对丰度存在差异;仿草包曲与对照块曲在黄酒发酵过程中的理化指标变化趋势相同,仿草包曲所酿黄酒的酒精度较对照块曲提高4.7%,氨基氮降低9.6%,总酸与还原糖变化趋势相同;风味物质中醇类与酯类物质较对照块曲分别增加51.06 mg/L与18.27 mg/L,醛类与酸类物质含量差异不显著。主成分分析结果表明:仿草包曲具有与对照块曲相近的发酵性能,熟麦曲的添加是仿草包曲与对照块曲发酵黄酒的风味组成差异显著的主要原因。
黄酒的特色是“以麦制曲,以曲酿酒”[1],因此,作为黄酒发酵过程中重要的糖化剂与产香剂[2],生麦曲对黄酒的品质与风味具有至关重要的影响。黄酒生麦曲历史悠久,历史上有过多次工艺改进,其中草包曲工艺是绍兴地区黄酒酿造的重要传统工艺[3]。草包曲与块曲都属于生麦曲。1973年以前生产黄酒,由于绍兴地区人工制曲时使用长杆稻草包裹曲块,所以称为“草包曲”,后受到当地种植矮脚稻的影响,可以制作草包曲的稻草来源逐渐减少;再加上传统草包曲制作工艺要求“上三缚松,下三缚紧”,工序繁重,因此越来越难以满足现代生产需要[4]。随着机械化制曲程度的提高,传统的草包曲逐渐被现代的机械块曲取代。机械制作的块曲节约人力、效率高、一次成型、标准化程度高,但存在“干皮”、过实、生产季节性与延滞性等问题[5-7]。因此,对生麦曲发酵工艺进行现代化改进及评价具有十分深远的意义[8]。
目前,关于黄酒生麦曲的评价研究主要集中在生麦曲的群落结构对黄酒风味的影响[9-11],以及不同种类或用量的生麦曲对黄酒发酵的影响[12-13],也有研究利用组学技术研究生麦曲中的微生物与代谢物的相关性[14],而对草包曲的相关应用研究较少。近年来,关于自动化制生麦曲的相关研究也表明:曲箱制曲是智能化的重要前提[15],但基于曲箱制曲对传统草包曲的工艺仿制与评价的相关研究仍处于初阶水平。本研究通过对传统草包曲的发酵环境进行分析与模拟制成仿草包曲,对比仿草包曲与对照块曲的酶活性能、微生物群落结构,再将仿草包曲与对照块曲进行黄酒发酵验证,比较所发酵黄酒的理化指标、挥发性与非挥发性风味物质的含量,并借助主成分分析比较和展示两种生麦曲的发酵性能的异同。
1.材料与方法
1.1 材料与试剂
糯米、生小麦购自无锡锡山区米市;对照块曲、熟麦曲由浙江省绍兴市古越龙山黄酒厂提供;黄酒酵母为本研究团队实验室菌库保藏菌株,编号为HJ。
糖化酶:2.78×105 U/mL,苏州宏达制酶有限公司;液化酶:1.40×105 U/mL,诺维信(中国)生物技术有限公司;3,5-二硝基水杨酸、NaOH、酒石酸钾钠、苯酚、亚硫酸钠等试剂均为分析纯,国药集团化学试剂有限公司;2-辛醇、甲醇、乙腈、氨基酸和有机酸等标品均为色谱纯,安谱实验科技股份有限公司。
1.2 仪器与设备
KC/HWS- 250PY型恒温恒湿培养箱,上海凯测实验设备有限公司;UV- 1800型紫外可见光分光光度计,上海美谱达仪器有限公司;Waters e2695型高效液相色谱系统,美国Waters科技有限公司;50/30 μm DVB/CAR/PDMS型萃取头,美国Supelco公司;10 mL顶空钳口样品瓶,安谱实验科技股份有限公司;Thermo Fisher TRACE 1300型气相色谱质谱联用仪,美国Thermo Fisher科技公司;DF- 101KS型集热式恒温加热磁力搅拌器,郑州恒岩仪器有限公司。
1.3 实验方法
1.3.1 仿草包曲制备工艺
仿草包曲制作工艺流程见图1,本研究使用医用纱布模拟在传统草包曲外侧包裹使用的稻草,采用绍兴市古越龙山黄酒厂生麦曲工艺,制成仿草包曲,其工艺流程见图1。

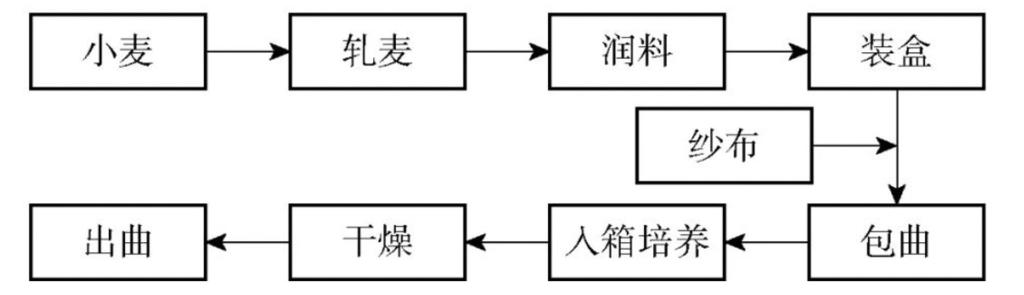
图1 仿草包曲的制作流程
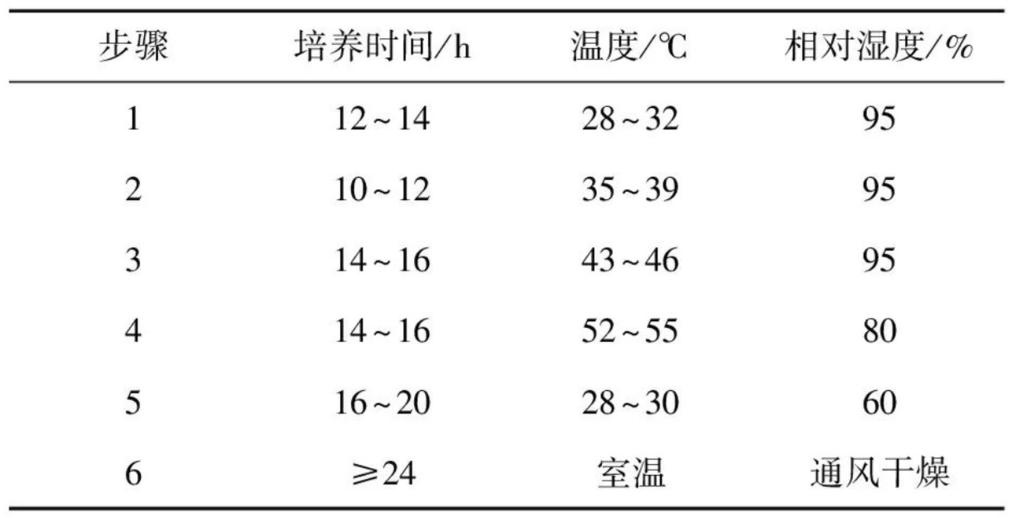
参考相关文献[1,4,16-17],经过预实验确定发酵温度与湿度参数,按照表1所述工艺在恒温恒湿培养箱中进行生麦曲发酵。
表1 仿草包曲制作工艺参数
1.3.2 黄酒的酿造工艺及取样要点
黄酒发酵模拟实验参考文献[18],并略作改动。设置2个分组,第1组:只添加生麦曲(质量分数占生糯米质量的13.5%)酿酒;第2组:生麦曲(质量分数占生糯米质量的11.7%)与熟麦曲(质量分数占生糯米质量的1.8%)混用酿酒。分别在发酵的24、72、120、168、240、360、480 h取样,进行理化指标、非挥发性风味物质、挥发性风味物质、杂醇含量等的检测。
1.3.3 黄酒和仿草包曲理化指标测定方法
酒精度、总酸、氨基酸态氮含量的测定参考文献[19],还原糖采用二硝基水杨酸法[20]进行测定,液化酶活力的测定参考文献[21]并略有改动,糖化酶活力与酸性蛋白酶活力的测定参考工业酶制剂通用实验方法QB/T 1803—1993[22],并略有改动。
1.3.4 黄酒挥发性风味物质测定方法
采用顶空固相微萃取(HS- SPME)结合GC- MS法[13]测定发酵黄酒中的挥发性风味物质含量。
1)样品前处理。取2 mL黄酒样品,加入4 mL纯水,2.5 g氯化钠以及10 μL内标溶液(2-辛醇,101.8 mg/L),于50 ℃下使用50/30 μm DVB/CAR/PDMS固相微萃取头平衡吸附50 min,270 ℃解吸5 min,用于GC- MS测定。
2)定性与定量分析。采用美国国家标准技术研究所(National Institute of Standards and Techno-logy,NIST)质谱数据库检索结合标准物质进行定性分析。同时采用SPME方法对外标混合物进行检测,通过外标法对黄酒中的挥发性风味物质进行全定量,得到各挥发性组分的质量浓度。
1.3.5 黄酒中杂醇的测定方法
采用GC- MS法测定发酵黄酒中的杂醇[9]。取3.5 mL黄酒样品置于15 mL离心管,加入3.5 mL纯水,1 mL乙腈,600 μL二氯甲烷,50 μL内标溶液(4-甲基-2-戊醇,16 848 mg/L),涡旋1 min混匀,5 000 r/min离心5 min,收集底部有机相,过0.22 μm滤膜后,用于GC- MS测定。
1.3.6 黄酒非挥发性风味物质测定方法
黄酒中的非挥发性风味物质,主要包括有机酸与氨基酸两类。本研究参考文献[11]采用HPLC法测定发酵黄酒中的有机酸;参考文献[23]采用HPLC法测定发酵黄酒中的游离氨基酸。
1.3.7 微生物群落结构分析方法
样品采用送样测序的方式由北京诺禾致源科技股份有限公司采用赛默飞NGS Ion S5平台进行16S rDNA的V3~V4区及内转录1区(internal transcribed spacer1, ITS1)高通量测序,每份样品做3个平行,测序结果经过质控后进行QIIME(quantitative insights into microbial ecology)流程分析,具体方法参考文献[10]。在99%相似度水平进行操作分类单元(operational taxonomic units,OTU)的聚类与生物信息统计分析,将序列信息与Silva(http://www.arb-silva.de/)数据库进行对比,筛选属水平相对丰度大于0.1%的微生物属进行群落结构对比分析,平行结果取均值后作图。
1.4 数据分析
利用SPSS Statistics 19.0与R(version 3.6.3)语言agricolae包进行ANOVA方差分析与差异显著性检验,采用Origin软件与SIMCA 14.1进行图像处理与主成分分析(principal component analysis,PCA),采用Graphpadprism 7制作堆积图与热图分析。所有实验均重复3次,结果用“平均值±标准差”表示。
2.结果与分析
2.1 仿草包曲与对照块曲的酶活性能比较
参考相关文献[1,4,16-17],基于恒温恒湿通风制曲工艺进行模拟,根据温度与湿度进行仿草包曲预实验,最终采用表1所述工艺参数进行仿草包曲的制作。工艺上,仿草包曲采用的是控温控湿发酵,不论是培养箱制曲还是放大至圆盘制曲,均可实现基于特定指标的工艺控制;时间上,仿草包曲的总发酵时间为6~10 d,较现有传统曲、机制曲、自动化生麦曲均有一定程度的缩短[8,15,24-25];感官上,仿草包曲比对照块曲颜色深,白色菌丝稠壮,有轻微霉味,呈现脆、粉的特征;而对照块曲呈黄白色,部分位置出现不均匀的棕褐色,碎粉较少,触感较硬,结构结实。
对仿草包曲与对照块曲的酶活性能进行测定,结果见表2。从表2可以看出,仿草包曲的含水量以及糖化力、液化力、蛋白酶活力等酶活指标均较对照块曲高,这可能是由于对照块曲的干燥时间更久,而仿草包曲的干燥时间较短,因此具有较高的酶活力。在实际生产中,较高的酶活力通常意味着起酵速度快,发酵效率高,酸罐的可能性较小,但也有可能导致前期糖化速度大于发酵产酒精的速度,进而导致酵母的生长抑制[26-27]。
表2 仿草包曲与对照块曲的酶活性能比较

*和**分别表示同列数据在P<0.05和P<0.01水平具有统计学意义。
2.2 仿草包曲与对照块曲的微生物群落结构对比
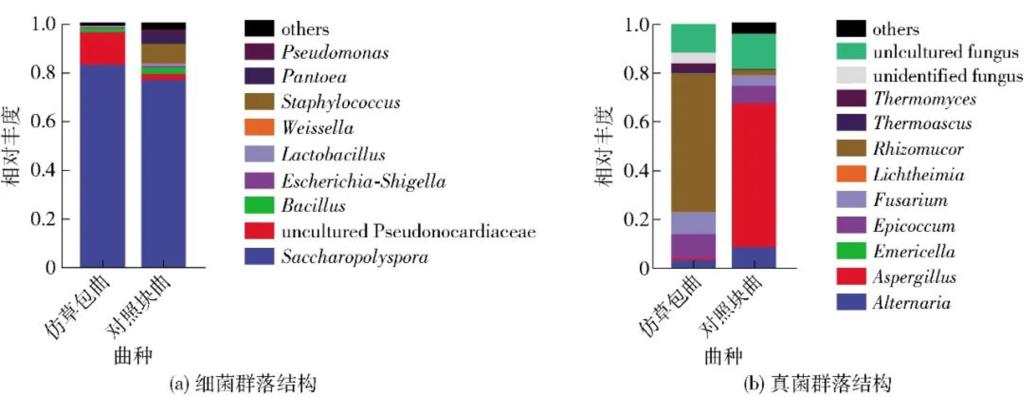
图2 仿草包曲与对照块曲的细菌与真菌属水平群落结构
仿草包曲及对照块曲的群落结构比较结果见图2。仿草包曲的细菌群落与对照块曲相似度较高,糖多孢菌属(Saccharopolyspora)作为主要细菌属,分别占82.4%和76.3%,对照块曲中含有总计相对丰度13.9%的葡萄球菌属(Staphylococcus)、泛菌属(Pantoea)、假单胞菌属(Pseudomonas)等未在仿草包曲中检测到的细菌属,而仿草包曲中不可培养的假诺卡氏菌科(uncultured Pseudonocardiaceae)的相对丰度比对照块曲高10.9%;真菌群落结构上二者种类差异较小,但不同属真菌相对丰度差异较大,尤其是仿草包曲中根毛霉属(Rhizomucor)高达56.8%,而对照块曲中曲霉属(Aspergillus)相对丰度为58.9%,分别是两种生麦曲中的主要真菌属。除此以外,其他真菌属的相对丰度差异较小。这可能是由于仿草包曲培养条件较适宜糖多孢菌属的生长有关,而真菌群落结构出现较大差异的原因,可能与发酵时间较短有关。据报道,不同发酵阶段的生麦曲群落结构显著不同,根毛霉属普遍出现在发酵中期,而曲霉属通常在发酵末期及储存较长时间后占据较多比例[10,28-30]。
2.3 仿草包曲与对照块曲发酵黄酒的理化指标对比
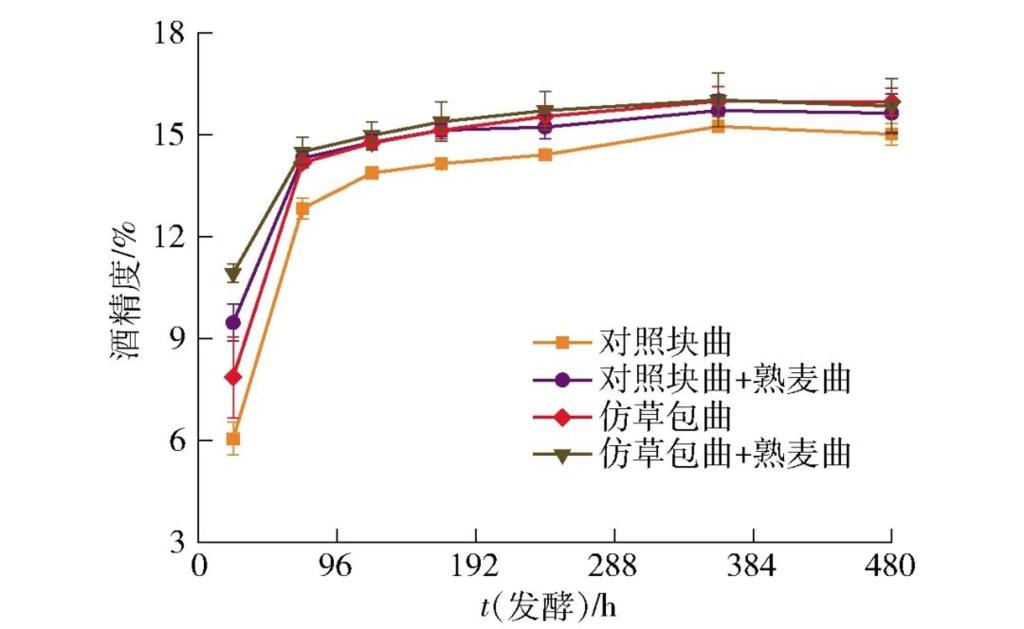
图3 不同曲种制备的黄酒发酵过程中酒精度变化
将仿草包曲与对照块曲进行黄酒酿造实验,酒精度、还原糖、总酸及氨基态氮的变化情况见图3至图5。从图3可以看出,混有熟麦曲的发酵组发酵启动迅速,酒精度增长快于只有生麦曲的组,前酵结束时的酒精度分别达到13.9%、14.8%、14.8%、15.0%,后酵结束时均达到15%以上,这说明4组样品均发酵正常,而仿草包曲在没有熟麦曲存在的条件下仍然能达到较好的发酵水平,其糖化力虽然较熟麦曲低[31],但仍能达到一个较好的发酵结果。
还原糖含量是反映酵母利用糖酵解途径产酒精能力的关键指标之一[32]。从图4还原糖含量变化情况来看,24 h时添加熟麦曲的实验组还原糖消耗量比只用生麦曲的实验组平均多26.20 g/L,这说明添加熟麦曲的2组发酵醪液中还原糖消耗速度均高于只用生麦曲组;但随着发酵进程的进行,在120 h时各组还原糖含量已经接近,这说明在只有生麦曲作为发酵剂的情况下,发酵启动虽慢,但前酵过程足以使醪液中的还原糖消耗至较低水平。
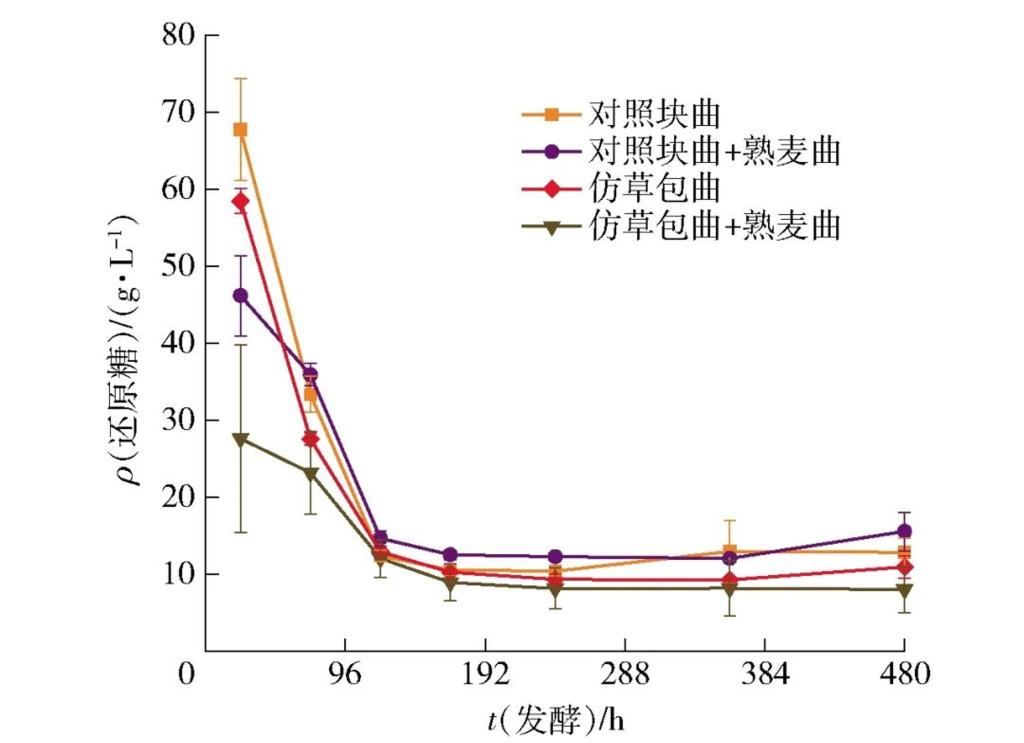
图4 不同曲种制备的黄酒发酵过程中还原糖含量变化
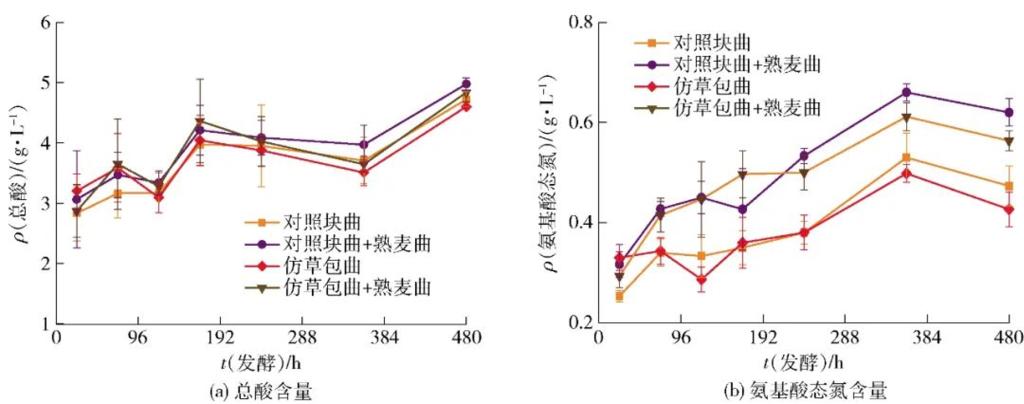
图5 不同曲种制备的黄酒发酵过程中总酸与氨基氮含量变化
“无酸不成味”,酸类化合物是黄酒中重要的呈味物质与风味前体,其与氨基酸态氮常一起作为发酵程度的判断指标[33]。由图5(a)可知,除对照块曲组的总酸在前酵期间(0~120 h)低于其他三组外,后酵期间(>120 h)各组总酸含量差异不显著(P>0.05),对照块曲加熟麦曲组总酸稍高于其他三组;而图5(b)氨基氮含量变化则反映出只有生麦曲组与添加熟麦曲组可显著分为两类(P<0.05),而仿草包曲的发酵样品在氨基态氮含量上与对照组没有显著差异(P>0.05)。
2.4 仿草包曲与对照块曲发酵黄酒的挥发性风味物质与杂醇对比
作为黄酒主要微生物来源的生麦曲被认为是黄酒风味的重要来源,因此对发酵黄酒风味物质的检测,也是反映生麦曲发酵性能的主要方法之一[34]。
对后酵结束后的样品进行挥发性风味物质与杂醇的检测,共检测出7种醇类、5种醛类、4种酸类、15种酯类及3种酚类,其含量见表3。由表3可知,对照块曲组黄酒的醇类物质含量高于仿草包曲组,4组黄酒的醛类与酸类物质含量接近,但仿草包曲组的酯类物质显著高于对照块曲组(P<0.05),且仿草包曲加熟麦曲组高于对照块曲加熟麦曲组;4-乙烯基愈创木酚是四组黄酒共有的一种主要酚类物质,黄酒中的酚类物质主要来源于麦曲,这说明仿草包曲与对照块曲在酿酒的风味指标方面也具有较高的相似性[35-37]。
酯类物质是黄酒中主要的芳香物质,是形成酒体香气浓郁的主要因素。两种生麦曲发酵的黄酒中含量较高的酯类物质主要是乙酸乙酯、乳酸乙酯、丁酸乙酯、己酸乙酯等,酯类物质占所检测的总挥发性风味物质比重超过17.84%。酯类物质中,乙酸乙酯的含量最高达到(100.37±3.78)mg/L,乳酸乙酯最高为(36.58±4.97)mg/L,均出现在仿草包曲所发酵的黄酒样品中,这说明仿草包曲较对照块曲有较高的产酯能力。仿草包曲发酵的黄酒中总醇类物质与总酯类物质含量较对照块曲分别高51.06 mg/L与18.27 mg/ L,醛类物质与酚类物质等含量较为接近。杂醇是黄酒中引起上头深醉的主要原因之一[38],因此杂醇的含量也被认为是黄酒舒适度与发酵性能的重要依据[27,39]。从表3可以看出,仿草包曲组黄酒总杂醇含量较对照块曲组低21.27 mg/L,这表明仿草包曲工艺具有广阔的应用前景。总的来说,仿草包曲所酿制的黄酒具有高酯低杂醇的特点,醇类与酸类物质则没有显著差异(P>0.05),这说明仿草包曲与对照块曲具有相近的产风味物质能力。
2.5 仿草包曲与对照块曲发酵黄酒的非挥发性风味物质对比
黄酒中的非挥发性风味物质,主要包括有机酸与氨基酸两类。图6是两种生麦曲发酵黄酒的有机酸含量及组成。由图6可知,仿草包曲的产酸能力较对照块曲低,尤其是在乙酸与乳酸含量上显著低于对照块曲组(P<0.05),但在表3中仿草包曲组与对照块曲组黄酒中乳酸乙酯与乳酸乙酯的含量没有较大差异,这可能与对照块曲中乳酸菌属等主要产酸菌的相对丰度显著高于仿草包曲有关。
氨基酸是黄酒中重要的呈味物质,不仅赋予黄酒独特的色泽,高含量的游离氨基酸还是黄酒的健康属性的体现[40]。经过检测可知,仿草包曲加熟麦曲组所酿黄酒中谷氨酸、亮氨酸、脯氨酸的含量分别比对照块曲组多257.56、220.24、260.34 mg/L,总游离氨基酸含量较对照块曲加熟麦曲组多2 435.13 mg/L,达到10.63 g/L,是对照块曲加熟麦曲组的1.30倍,这与前文所述仿草包曲具有较高的酸性蛋白酶活力相一致。图7是两种生麦曲发酵黄酒的游离氨基酸含量热图。由图7可以看出,不论添加熟麦曲与否,仿草包曲与对照块曲所酿黄酒中的游离氨基酸含量均较为接近。
表3 黄酒中的主要挥发性风味物质及含量
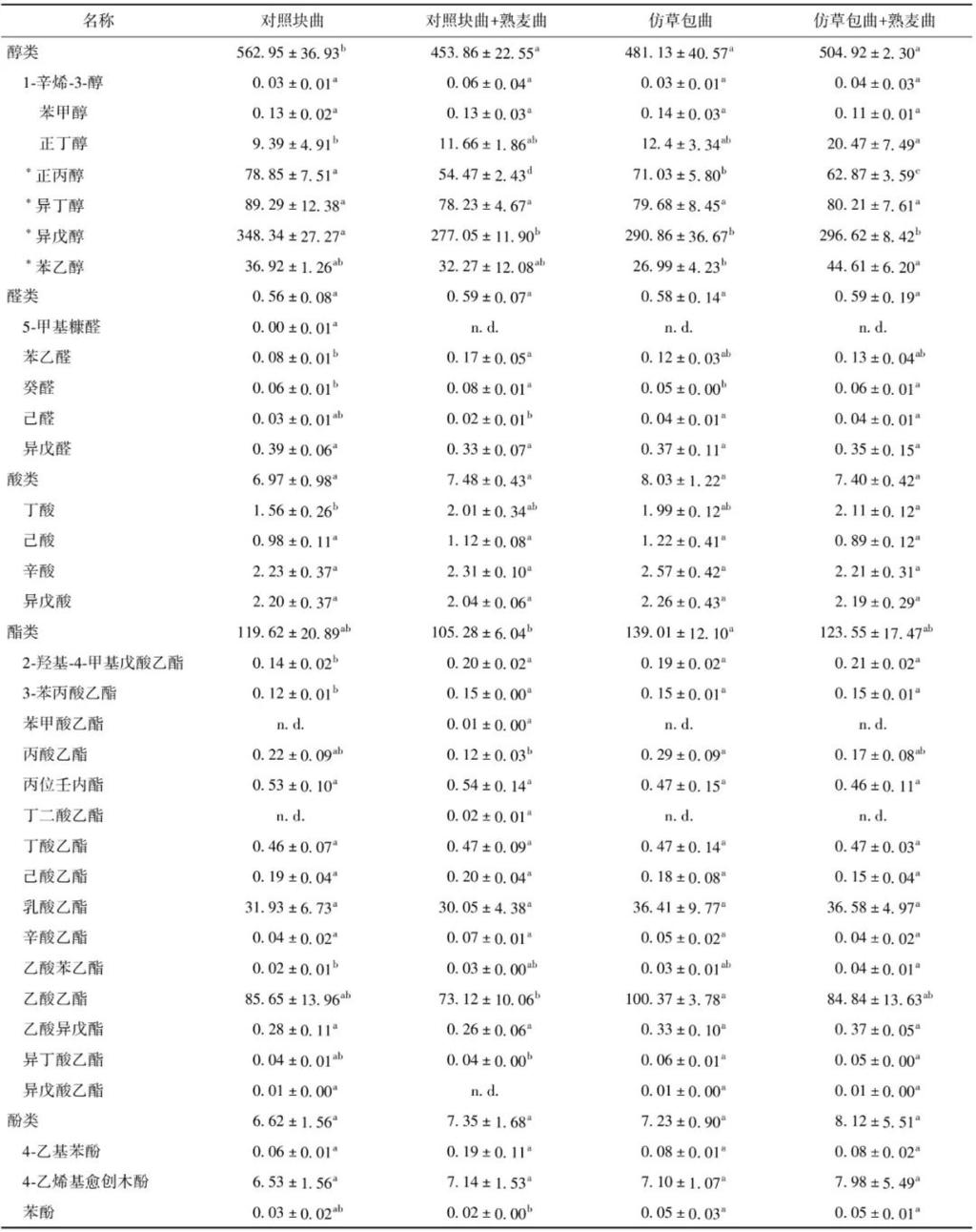
同行中不同小写字母表示不同样品组间差异显著(P<0.05);n.d.表示未检测到;*表示该物质为杂醇,采用1.3.5节方法定量。

图6 不同曲种制备黄酒的有机酸组成与含量
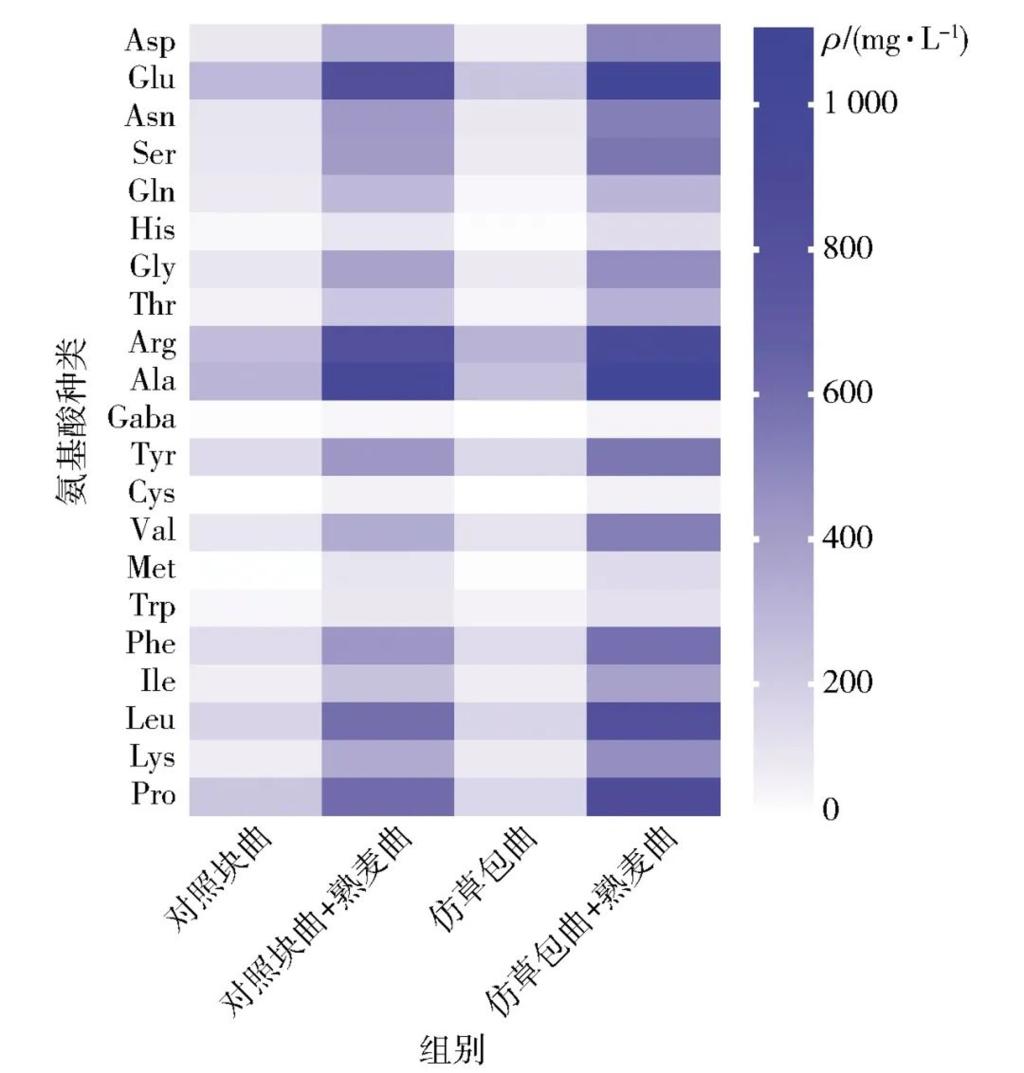
图7 不同曲种制备黄酒的游离氨基酸含量热图
2.6 基于风味物质的PCA分析
对挥发性风味物质与非挥发性物质数据进行标准化处理后,对4组样品进行PCA聚类分析,结果见图8。提取3个主成分,其组合解释率达71.6%,其中PC1可以解释46.7%的总体情况。从图8可以看出,在第一主成分上,只用生麦曲和生、熟麦曲混用所发酵的黄酒各自聚在一起,说明仿草包曲与对照块曲的发酵性能接近,熟麦曲的添加是影响黄酒品质的主要原因;而在PC2上仿草包曲组与对照块曲组重合较多,说明仿草包曲在应用过程中与对照块曲具有一定的相似性,但熟麦曲的使用则是扩大仿草包曲与对照块曲黄酒风味差异的重要原因。
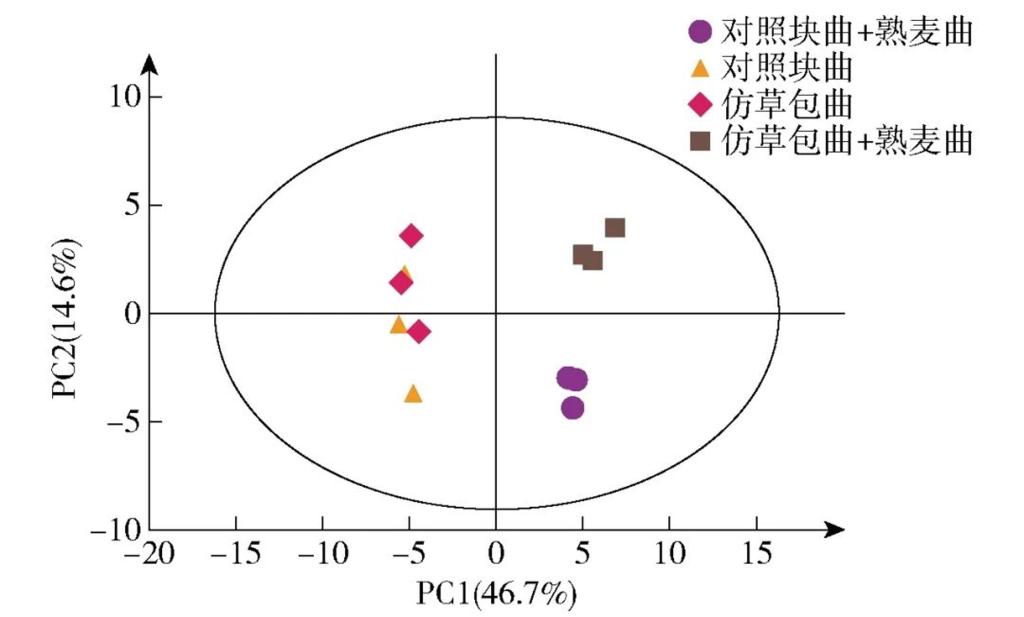
图8 基于两种生麦曲发酵黄酒的风味物质的PCA聚类图
3.结论
本研究对仿草包曲与对照块曲分别进行发酵黄酒的理化指标与风味物质对比。结果表明:从酶活性能来看,仿草包曲的3种酶活性均显著高于机械块曲(P<0.05);从微生物群落结构来看,仿草包曲细菌群落结构与对照块曲相似度较高,但根毛霉属与曲霉属的相对丰度差异较大;从发酵情况来看,仿草包曲所发酵的黄酒酒精度上升趋势与对照块曲一致,还原糖、总酸与氨基氮的变化也具有相同的趋势;从挥发性风味物质来看,仿草包曲发酵的黄酒中总醇类物质与总酯类物质含量较对照块曲分别高51.06 mg/L与18.27 mg/L,醛类物质与酚类物质等含量较为接近;从非挥发性风味物质来看,仿草包曲组的有机酸总量显著低于对照块曲组,而氨基酸总量显著高于对照块曲组(P<0.05)。PCA结果表明,仿草包曲与对照块曲的发酵性能与风味组成较为接近,聚类情况较好,但熟麦曲的添加是造成两种曲发酵黄酒风味显著差异的主要原因仿草包曲低酸高酯的发酵特征则表明其可用于发酵清爽型或特型黄酒,此外,仿草包曲在白酒、红曲黄酒、香醋、酱油的发酵过程中也具有优异的应用潜力。
总的来说,仿草包曲具有与机制块曲相当的发酵性能。本研究着重于分析仿草包曲在黄酒发酵中的应用与风味评价,在微生物群落结构方面的研究还不够深入,后续还可从微生物与风味的相关性等方面进行生麦曲与黄酒质量的相关研究,或从原料、工艺、机理解析等角度着手研究生麦曲的智能化制造的潜能,为制曲工艺优化与现代制曲方法提供借鉴。
参考文献(略)
引用格式:周志立,刘双平,徐岳正,等.仿草包曲在黄酒发酵中的应用及其对黄酒风味的影响[J]. 食品科学技术学报,2021,39(5):135-144.
ZHOU Zhili,LIU Shuangping,XU Yuezheng,et al. Application of imitated Caobao koji in Huangjiu fermentation and its influence on Huangjiu Flavor[J]. Journal of Food Science and Technology, 2021,39(5):135-1
基金项目:国家重点研发计划项目(2018YFD0400401);国家自然科学基金面上项目(32072205;31771968);中央高校基本科研业务费专项资金资助项目(2050205);2019江苏省科协青年科技人才托举工程项目;绍兴市科技计划专项项目(2018A22001;2019B11001)。
转载|食品科学技术学报
